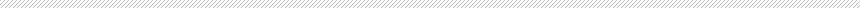前言
2025年1月,日本东京大学医学科学研究所病毒学部川冈义弘教授团队于《Nat Commun》(Q1,IF,14.7)杂志上发布了文章“中性粒细胞粘附血管壁导致COVID-19肺灌注受损”。该研究表明:
①中性粒细胞和血小板复合成的微血栓会损害肺血流并加重 COVID-19 肺炎。SARS-CoV-2 感染后,肺血管内中性粒细胞数量增加,运动能力下降;并与聚集的血小板复合,频繁形成中性粒细胞-血小板复合物,导致红细胞流经肺部时可进行氧气交换的血管数量减少。
②在感染 SARS-CoV-2 的小鼠肺部,血管内中性粒细胞粘附分子表达增加,延长了与血管壁的粘附时间,导致血小板聚集和肺灌注受损。
③重新分析 COVID-19 病例外周血单核细胞的 scRNA-seq 数据发现,与健康组相比,严重 COVID-19 病例中性粒细胞中 CD44 和 SELL 的表达水平升高。
文章摘要
微血栓的形成与 COVID-19 的严重程度有关,但其具体机制仍不清楚。在本研究中,我们利用体内双光子成像系统研究了由 SARS-CoV-2 感染引起的重症肺炎小鼠模型。在感染 SARS-CoV-2 的小鼠肺部,血管内中性粒细胞粘附分子表达增加,延长了与血管壁的粘附时间,导致血小板聚集和肺灌注受损。重新分析 COVID-19 病例外周血单核细胞的 scRNA-seq 数据发现,与健康组相比,严重 COVID-19 病例中性粒细胞中 CD44 和 SELL 的表达水平升高,这与我们在小鼠模型中的观察结果一致。这些发现表明,中性粒细胞粘附在肺血管上导致的肺灌注缺陷是造成 COVID-19 严重程度的原因之一。
简介
严重急性呼吸系统综合征冠状病毒-2(SARS-CoV-2)是 COVID-19的致病病毒,通过含有病毒的飞沫/气溶胶传播。SARS-CoV-2 通过血管紧张素转换酶-2(ACE-2)作为受体与肺泡上皮细胞结合,开始入侵肺部。大多数 COVID-19 病例的呼吸道症状较轻,如发烧、咳嗽、流鼻涕和咽炎;然而,老年人和患有肥胖症、糖尿病和高血压等基础疾病的患者会患上重症病毒性肺炎,这往往会导致严重的并发症,甚至死亡。重症病毒性肺炎患者根据其呼吸道和全身症状接受治疗,但 COVID-19 严重性的机制尚未完全明了,最佳治疗策略也尚未确立。
免疫病理,包括中性粒细胞增多和淋巴细胞减少、I 型干扰素反应减弱或延迟以及单核细胞和粒细胞失调引起的细胞因子风暴,可能在 COVID-195 的发病机制中发挥作用。除了这些免疫病理机制外,严重 COVID-19 患者中还常有血栓形成的报道,这也可能导致疾病的严重性。血小板通过中性粒细胞释放的中性粒细胞胞外诱捕网(NETs)与中性粒细胞结合,形成大的血栓样聚集体;血小板还可独立于中性粒细胞形成血栓,对暴露于受损内皮细胞的组织因子做出反应。利用临床样本和 SARS-CoV-2 感染动物模型的单细胞 RNA-seq 和蛋白质组学方法发现,与炎症、凝血和 NETs 释放相关的因子在 SARS-CoV-2 感染期间被激活。参与血栓形成的因素受时空调控,血栓形成过程被认为是一个多步骤的过程;然而,这些动态事件很难通过 COVID-19 尸检样本或感染 SARS-CoV-2 的动物的传统组织学方法进行观察。因此,目前仍不清楚重症 COVID-19 患者血栓形成的过程。
要为重症 COVID-19 患者制定有效的治疗方法,我们必须阐明疾病严重程度的相关机制。为了了解 SARS-CoV-2 如何影响肺血管中血小板和中性粒细胞的反应以及血栓形成反应,我们利用 SARS-CoV-2 株系和致死小鼠模型对 SARS-CoV-2 感染后的细胞反应进行了双光子体内成像分析。我们的活体成像分析表明,SARS-CoV-2 感染小鼠肺血管中的中性粒细胞数量增加,中性粒细胞与肺血管的粘附时间延长,血小板聚集增强。中性粒细胞在肺血管中粘附因子表达的增加促进了血栓的形成,并损害了 SARS-CoV-2 感染小鼠肺部的血流量。此外,对人类临床样本数据的重新分析证明了小鼠研究结果的相关性。
结果
1
SARS-CoV-2感染肺的体内成像
为了阐明 SARS-CoV-2 感染的肺在活体动物中的病理变化,我们使用以前在生物安全等级 (BSL) 3 设施中建立的体内成像系统对 K18-人血管紧张素转换酶-2 转基因(K18-hACE2 Tg)小鼠进行了检测。hACE2 在 K18-hACE2 小鼠的肺、肾、肝、肠和脑的上皮细胞中表达,并作为 S 蛋白的受体参与 SARS-CoV-2 感染的建立。为了观察 SARS-CoV-2 感染的细胞,K18-hACE2 Tg 小鼠经鼻接种了 SARS-CoV-2-Venus 病毒,该病毒在感染细胞中表达 Venus 荧光报告基因。SARS-CoV-2-Venus是在pBAC SARS2 WK521(来源于SARS-CoV-2/JPN/TY/WK521)骨架中通过反向遗传学产生的,在K18-hACE2 Tg小鼠中表现出致死性感染,MLD50(小鼠致死剂量50;杀死50%感染小鼠所需的剂量)值为103.83斑块形成单位(PFU)(图1a)。为了分析 SARS-CoV-2 的病理生物学效应,我们用 105 PFU 的 SARS-CoV-2-Venus 感染了 K18-hACE2 Tg 小鼠。我们还为小鼠静脉注射了荧光葡聚糖以及荧光色素结合的抗小鼠 Ly-6G 和 CD41 抗体,以分别观察肺血管结构、中性粒细胞和血小板。感染后第4天,SARS-CoV-2感染小鼠的肺部开始出现病毒感染的金星阳性上皮细胞,到第6天时其数量明显增加(图1b和补充影片1)。金星阳性感染细胞从形态上看是环绕肺泡的扁平 I 型肺泡上皮细胞,而球形的大型 II 型肺泡上皮细胞感染了 SARS-CoV-2-Venus (图 1c),这与之前的研究一致12,13。血小板和中性粒细胞在未感染小鼠的肺毛细血管中流动顺畅,而在感染了 SARS-CoV-2-Venus 的小鼠中,它们在毛细血管中的移动速度较慢(补充影片 1)。感染 K18-hACE2 Tg 小鼠的肺毛细血管中,中性粒细胞的数量在第 6 天时明显增加(图 1d)。

图 1 SARS-CoV-2 感染 K18-hACE2 C57BL/6J 小鼠的体内成像。 a SARS-CoV-2-Venus 感染小鼠的存活率和体重变化。用 101 -105 PFU 的 SARS-CoV-2-Venus 感染 K18hACE2 C57BL/6J 小鼠,连续 10 天每天监测存活率和体重。b SARS-CoV-2 感染肺部的病理生理变化。K18-hACE2 C57BL/6J 小鼠经鼻感染 SARS-CoV-2-Venus 并在指定时间点进行观察。c 感染后 4 天(dpi)SARSCoV-2 感染细胞的体内成像。(i)和(ii)是最左侧图像的放大图。d SARS-CoV-2 感染肺部血管内中性粒细胞的数量。在 6 dpi,观察感染 SARS-CoV-2-Venus 的 K18-hACE2 C57BL/6J 小鼠,并计数显微镜视野内肺部毛细血管中的中性粒细胞。b-d 绿色表示病毒感染细胞。在指定的时间点,分别静脉注射荧光葡聚糖(白色)、荧光色素结合的抗小鼠 Ly-6G 抗体(红色)和抗小鼠 CD41(青色),以观察肺部结构、中性粒细胞和血小板。
2
SARS-CoV-2改变了血管内中性粒细胞的运动能力,并损害了感染肺的血流量
为了分析 SARS-CoV-2 感染肺部中性粒细胞的功能变化,我们对中性粒细胞的运动进行了定量评估。在之前的研究中,我们曾报道流感病毒感染小鼠的肺中性粒细胞表现出两种运动:一种是 “慢速运动”,即中性粒细胞以每秒 50 微米或更低的速度沿血管壁移动,这种运动被认为是系留或滚动;另一种是 “快速运动”,即中性粒细胞以每秒 50 微米以上的速度在血流中移动。我们分析了感染 SARS-CoV-2Venus 的 K18-hACE2 Tg 小鼠肺部中单个中性粒细胞参与每种运动的时间。我们追踪了在感染 SARS-CoV-2 的肺中观察到的肺中性粒细胞(图 2a 左侧面板),并根据它们在慢速运动中所花费的时间进行了排序,然后绘制了每个中性粒细胞在慢速运动(图 2a 右侧面板,蓝条)和快速运动(图 2a 右侧面板,红条)中所花费的总时间(补充影片 2)。在 SARS-CoV-2-Venus 感染的肺中,与未感染的肺相比,中性粒细胞在慢速运动中所花费的时间明显增加(图 2b)。我们还发现,参与快速运动的中性粒细胞比例下降(图 2b)。这些结果表明,SARS-CoV-2 感染肺中的血管中性粒细胞与肺血管壁的接触时间增加。
肺血管中血栓的形成已成为 COVID-19 肺炎的典型临床特征。为了评估血管内中性粒细胞是否有助于 SARS-CoV-2 发病过程中血栓的形成,我们通过共同染色血小板和中性粒细胞进行了体内成像分析。为了量化受感染肺部血小板聚集的大小,我们从原始图像中评估了作为血小板表面标志物的 CD41 荧光信号,测量了每个血小板的面积,并进行了频率分析(图 2c)。占地面积小(<50 像素,在我们的成像环境中约为 8.57 µm2)且在血管中流动的 CD41 信号被认为是单个血小板。在 SARS-CoV2 感染的肺中,还观察到聚集血小板的比例增加,其 CD41 信号面积较大(≥50 像素和 <200 34.28="">200 像素)堵塞血管成为栓子。在 SARS-CoV-2 感染的肺中,聚集的血小板和血栓的比例明显增加(图 2c)。有趣的是,在感染 SARS-CoV-2-Venus 的肺中,聚集的血小板经常与血管内的中性粒细胞相互作用,形成微血栓样结构(中性粒细胞-血小板复合物)(图 2d 和补充图 1)。与未感染的小鼠相比,SARS-CoV-2 感染小鼠肺部血管内中性粒细胞与血小板接触的比例明显增加(图 2d)。这些观察结果表明,SARS-CoV2 感染肺中附着在肺血管上的中性粒细胞参与了血小板聚集的形成。
在 SARS-CoV-2 感染肺中观察到的血液中性粒细胞停滞、血小板聚集和血小板-中性粒细胞复合物的形成可能会对由红细胞介导的肺血液动力学和氧交换产生重大影响。为了验证这一概念,我们将荧光标记的红细胞转移到感染了 SARSCoV-2 的 K18-hACE2 Tg 小鼠体内,并观察其轨迹 10 分钟。延时图像每 50 帧重叠一次,以观察标记红细胞流动的区域(图 2e 和补充影片 3)。在天真小鼠中,使用荧光葡聚糖观察到的血管和标记红细胞的流动轨迹几乎重叠,这表明大多数肺血管都具有氧气交换功能。相比之下,在 SARS-CoV-2 感染的肺中,有些区域的血管结构和标记红细胞的轨迹并不重叠,这表明可用于氧交换的功能性毛细血管减少了。血液中性粒细胞停滞、血小板聚集以及血小板-中性粒细胞复合物可能会扰乱 SARS-CoV-2 感染肺部的肺微循环。我们的活体成像数据显示,感染 SARS-CoV-2 的小鼠肺毛细血管功能衰竭可能是由于微血栓形成所致

图 2 SARS-CoV-2 感染肺部病理生理变化的定量分析。 a 肺血管内中性粒细胞对 SARS-CoV-2 感染的运动反应。通过追踪分析获得单个中性粒细胞的运动轨迹(左图,血管结构以白色显示,单个运动轨迹以不同颜色编码)。对于每个中性粒细胞,测量其轨迹中各个步骤的速度,然后将其定义为慢速(≤50 µm/s)或快速(>50 µm/s)。在相同条件下观察到的所有中性粒细胞根据其慢速运动的持续时间沿 y 轴排列。b 在 SARS-CoV-2-Venus 感染的肺中,中性粒细胞参与慢速运动的平均时间(左图)和参与快速运动的中性粒细胞的平均百分比(右图)。d K18-hACE2 C57BL/6J 小鼠经鼻感染 SARS-CoV-2-Venus 并在 6 dpi 时进行观察。在此时间点,静脉注射荧光葡聚糖(白色)、荧光色素结合的抗小鼠 Ly-6G 抗体(红色)和抗小鼠 CD41(青色),以分别观察肺部结构、中性粒细胞和血小板(左图)。箭头表示血小板聚集。计数显微镜视野内肺部毛细血管中与血小板复合的中性粒细胞数量,并绘制与中性粒细胞总数的比率图(右图)。n = 4 只生物学上独立的动物。e SARS-CoV-2Venus 感染小鼠的肺血液灌流。为了观察红细胞通过的血管,在指定时间点给感染 SARS-CoV-2-Venus 的 K18-hACE2 C57BL/6J 小鼠静脉注射荧光标记的红细胞(红色)。同时给小鼠静脉注射荧光葡聚糖(蓝色),以观察肺部结构。白圈表示在观察期间红细胞没有通过SARS-CoV-2-Venus感染的K18-hACE2 C57BL/6J小鼠肺部的血管。每个点代表一只动物的数据,横杠代表平均值 ± SD。
3
建立严重 SARS-CoV-2 肺炎小鼠模型
尽管 K18-hACE2 Tg 小鼠已被广泛用于研究 SARS-CoV2 的致病机理,但鼻内接种 SARS-CoV-2 可导致严重的神经系统疾病,包括脑炎,其特征与严重的 COVID-19 病例不同。我们先前建立了一种小鼠适应型(MA)SARS-CoV-2 及其表达维纳斯蛋白的衍生物(命名为 MA-SARS-CoV-2-维纳斯),它可导致 C57BL/6J 小鼠出现与严重 COVID-19 病例相似的严重肺部炎症。
为了建立一个能模拟严重 COVID-19 患者症状的动物模型,我们使用了七个已被证实为疾病模型的小鼠品系[即 肥胖/糖尿病模型,C57BL/6J HamSlc-ob/ob (Ob/Ob) 小鼠和 KK-Ay /Ta Jcl 小鼠;1 型糖尿病模型,链脲佐菌素(STZ)诱导的糖尿病 C57BL/6J 小鼠;衰老模型,SAMP8/TaSlc 小鼠和 SAMP10-ΔSglt2 小鼠;高脂血症模型,B6. B6.KOR/StmSlc-Apoeshl小鼠;以及肝炎模型--B6-神经性酒精性脂肪性肝炎(NASH)小鼠]。这些小鼠经鼻内感染 103 PFU 的 MA-SARS-CoV-2,并对其存活率进行评估。与野生型小鼠相比,感染 MA-SARS-CoV-2 的 Ob/Ob 小鼠存活率明显降低(图 3a)。其他六个品系的小鼠在感染 SARS-CoV-2 后没有出现任何症状(图 3a)。我们没有对这些其他小鼠合并症模型进行任何其他研究,因此无法解释为什么我们没有看到它们出现严重后果。MA-SARS-CoV-2 具有高致病性,其 MLD50 值为 102.5 PFU,可导致 Ob/Ob 小鼠体重下降(图 3b)。MA-SARS-CoV-2 和 MA-SARS-CoV-2-Venus 对 Ob/Ob 小鼠的致病力相当(MLD50;102.5 PFU)(补图 2)。

图 3MA-SARS-CoV-2 在潜在疾病小鼠模型中的毒性。a Ob/Ob 小鼠、STZ 诱导的糖尿病 C57BL/6J 小鼠、KK-Ay /Ta Jcl 小鼠、SAMP8/TaSlc 小鼠、SAMP10-ΔSglt2 小鼠、B6. 用 103 PFU 的 MASARS-CoV-2 感染 KOR/StmSlc-Apoeshl 小鼠和 B6-NASH 小鼠,并在指定时间点每天监测存活率。年龄和性别匹配的 C57BL/6J 小鼠作为对照组。SAMR1/TaSlc 小鼠作为 SAMP8/TaSlc 小鼠和 SAMP10-ΔSglt2 小鼠的对照。b Ob/Ob 小鼠每组 5 只,用 101 -104 PFU 的 MA-SARS-CoV-2 感染,每天监测存活率和体重,持续 10 天。结果以平均值 ± SD 表示。
用MA-SARS-CoV-2感染Ob/Ob小鼠后,在2 dpi时,肺部和鼻甲中的病毒滴度较高,在此时间点,Ob/Ob小鼠呼吸器官中的病毒滴度与对照组无明显差异(图4a)。受感染的 Ob/Ob 小鼠的脑部和肝脏中也回收到了病毒,尽管滴度较低(注:为进行病毒滴定而采集的脑部样本包括嗅球)。5 dpi时,在受感染的Ob/Ob小鼠肺部,病毒复制明显高于对照组,滴度超过1.0 × 107 PFU/g。相比之下,Ob/Ob小鼠鼻甲中的病毒滴度与对照组没有差异,而且在5 dpi检测的其他器官中也未检测到病毒。显微 CT 分析显示,MA-SARS-CoV-2 感染的 Ob/Ob 小鼠肺部出现异常,包括在 4 dpi 时出现与 COVID-19 肺炎一致的斑块状和界限不清的区域(图 4b)。
然后,我们检查了感染 MA-SARS-CoV-2 后 Ob/Ob 小鼠器官的组织病理学变化。组织病理学分析显示,在感染 MA-SARS-CoV-2 2 dpi 时,中性粒细胞和单核细胞等炎性细胞浸润了 Ob/Ob 组和对照组的肺泡区域(图 4c)。在同一时间点,两组的病毒抗原主要在肺泡和支气管上皮细胞上进行免疫组化检测。此外,奥布/奥布组和对照组的肺炎组织病理学评分相当(图 4d)。出生后第 5 天,对照组的炎症有所改善,但奥布/奥布小鼠的炎症持续存在。在对照组中,病毒阳性细胞的数量明显减少。相反,奥布/奥布组的病毒阳性细胞数量没有明显减少。肺炎的组织病理学评分也证实了这些发现,对照组的肺炎评分明显下降,而奥布/奥布组的肺炎评分没有明显下降(图 4d)。流式细胞术显示,与对照组相比,MA-SARS-CoV-2 感染组肺部浸润的中性粒细胞和单核细胞数量显著增加(图 4e),这与组织病理学分析结果一致。

图 4 感染 MA-SARS-CoV-2 的 Ob/Ob 小鼠的特征。a 感染 MA-SARS-CoV-2 的小鼠器官中的病毒滴度。每组四只小鼠安乐死,在 VeroE6/TMPRSS2 细胞中使用斑块法测定肺、鼻甲、脑、心、肝、脾、肾和肠中的病毒滴度。b 感染小鼠肺部的显微 CT 成像。感染 MA-SARS-CoV-2 的 C57BL/6J 小鼠和 Ob/Ob 小鼠胸部的轴向 CT 图像。感染后第 4 天,MA-SARS-CoV-2 感染的 Ob/Ob 小鼠的肺部异常程度高于感染的 C57BL/J 小鼠,红色圆圈突出显示。所示为肺部的代表性图像。左列和中列显示苏木精和伊红染色。箭头所指为炎症细胞浸润区域。右栏显示使用兔多克隆抗体进行的免疫组化,该抗体可检测 SARS-CoV-2 核壳蛋白,棕色染色表示病毒阳性细胞。d 肺泡炎症的组织病理学评分。e MA-SARS-CoV-2 感染小鼠肺部免疫细胞数量。通过流式细胞术测定 C57BL/6J 小鼠和 Ob/Ob 小鼠在 4 dpi 时全肺的肺免疫细胞数量。
这些结果表明,Ob/Ob小鼠感染MA-SARS-CoV-2或MA-SARS-CoV-2-Venus是反映严重COVID-19发病机制的有用模型。
4
中性粒细胞导致 SARS-CoV2 感染肺灌注受损
为了分析MA-SARS-CoV-2感染的Ob/Ob小鼠的病理生物学变化,用104 PFU的MASARS-CoV-2-Venus经鼻感染小鼠。第 4 天下午,在 Ob/Ob 小鼠肺部观察到大量感染细胞(图 5a 和补充影片 4)。与感染 K18 hACE2 Tg 小鼠的病理生理变化类似,感染 MA-SARSCoV-2-Venus 的 Ob/Ob 小鼠肺血管中的中性粒细胞、血小板聚集、血栓数量以及中性粒细胞与血小板接触的比例都显著增加(图 5b-d)。为了研究中性粒细胞的功能变化,我们量化了感染小鼠血管中性粒细胞的运动能力。与对照组相比,感染MA-SARS-CoV-2-Venus的Ob/Ob小鼠肺血管中中性粒细胞的慢速运动明显增加,表明中性粒细胞与肺血管壁的粘附时间增加(图5e,f)。MA-SARS-CoV-2Venus感染的Ob/Ob小鼠肺血液动力学显示,与感染的野生型小鼠相比,肺灌注明显受损,可用于氧气交换的毛细血管有限(图6a和补充影片5)。
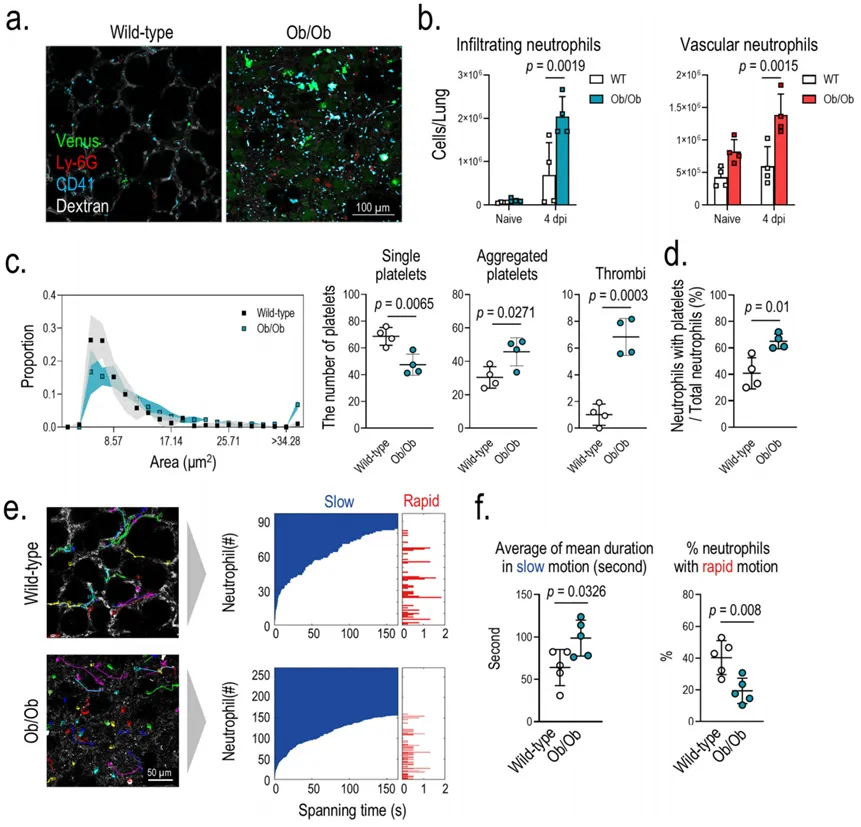
图 5 SARS-CoV-2 感染 Ob/Ob 小鼠的体内成像 a SARS-CoV-2 感染 Ob/Ob 小鼠肺部的病理生理变化。用 104 PFU MA-SARS-CoV-2-Venus 经鼻感染 Ob/Ob 小鼠,并在感染后 4 天(dpi)进行观察。绿色表示病毒感染细胞。b MA-SARS-CoV-2 感染肺部的浸润性和血管性中性粒细胞。Ob/Ob 小鼠经鼻感染 103 PFU 的 MA-SARS-CoV-2,感染肺在 4 dpi 时通过流式细胞术进行分析。d 感染 MA-SARS-COV-2-Venus 的 Ob/Ob 小鼠肺部中性粒细胞与血小板复合的比率。对显微镜视野中肺部毛细血管中与血小板复合的中性粒细胞数量进行计数,并绘制与中性粒细胞总数的比率图。e MA-SARS-CoV-2 感染小鼠肺部血管内中性粒细胞的运动性。为了追踪中性粒细胞的运动,向感染 MA-SARS-CoV-2-Venus 的 Ob/Ob 小鼠静脉注射含荧光色素的抗小鼠 Ly-6G 抗体。进行追踪分析以获得单个中性粒细胞的运动轨迹(左图,血管结构以白色显示,单个运动轨迹以不同颜色编码)。在 MA-SARSCoV-2-Venus 感染的肺中,中性粒细胞参与慢速运动的平均时间(左侧面板)和快速运动的中性粒细胞平均百分比(右侧面板)。b-d, f 每个点代表一只动物的数据,横杠代表平均值 ± SD。
为了弄清中性粒细胞和血小板聚集是否是导致 SARS-CoV-2 感染肺灌注受损的原因,我们使用体内成像方法进行了五色多重标记分析。Ob/Ob 小鼠经鼻感染 MA-SARS-CoV-2-Venus,并在 4 dpi 时进行观察。在此时间点,静脉注射荧光葡聚糖、两种荧光抗体(Ly-6G 和 CD41)和荧光标记红细胞,然后使用我们的成像系统进行观察。在感染 MA-SARS-CoV-2-Venus 的 Ob/Ob 小鼠肺中,中性粒细胞和血小板聚集阻碍了转移红细胞的流动,这表明这些聚集可能是导致肺灌注受损的原因(图 6b 和补充影片 6)。此外,在 SARS-CoV-2 感染的肺中,中性粒细胞粘附在肺血管上,随后血小板聚集,转移的红细胞淤积,这表明中性粒细胞粘附在血管壁上是血栓形成和随后肺灌注受损的起源点。
为了评估中性粒细胞是否参与了MA-SARS-CoV-2的发病机制,我们使用抗体清除了体内的中性粒细胞,并分析了其对病毒易感性的影响。清除Ob/Ob小鼠的中性粒细胞后,MA-SARS-CoV-2感染后肺血管中的单个血小板数量略有增加,聚集血小板和血栓数量减少(图6c)。此外,感染 MA-SARS-CoV-2 后,中性粒细胞缺失的 Ob/Ob 小鼠存活期延长(图 6d)。这些结果表明,中性粒细胞停滞时形成的血栓可能会加剧 Ob/Ob 小鼠的 MA-SARS-CoV-2-Venus 肺炎。

图 6 MA-SARS-CoV-2-Venus感染的Ob/Ob小鼠肺部的血液动力学 a MA-SARS-CoV-2-Venus感染的小鼠肺部血液灌流。为了观察红细胞通过的血管,在指定时间点给感染 MA-SARS-CoV2-Venus 的 Ob/Ob 小鼠静脉注射荧光标记的红细胞(红色)。小鼠还静脉注射了荧光葡聚糖(蓝色),以观察肺部结构。b MA-SARS-CoV-2-Venus 感染的 Ob/Ob 小鼠中性粒细胞-血小板复合物导致肺微循环受损的代表性图像。Ob/ Ob 小鼠经鼻感染 MA-SARS-CoV-2-Venus,并在 4 dpi 时进行观察。在此时间点,静脉注射荧光葡聚糖(白色)、荧光色素结合的抗小鼠 Ly-6G 抗体(红色)和抗小鼠 CD41(青色),以分别观察肺部结构、中性粒细胞和血小板。小鼠还静脉注射了荧光标记的红细胞(红色)。白色箭头表示粘附在肺血管壁上的中性粒细胞(紫红色)。黄色箭头表示血小板(青色)聚集,白色箭头表示红细胞通过血管受阻。c 感染 MA-SARS-CoV-2 的中性粒细胞缺失 Ob/Ob 小鼠血小板聚集的定量评估。给 Ob/Ob 小鼠注射抗 Kappa 免疫球蛋白抗体和抗 Ly-6G 抗体以消耗中性粒细胞。用 104 PFU 的 SARS-CoV-2-Venus 感染小鼠,然后在感染后第 4 天给小鼠静脉注射氟铬结合的抗小鼠 CD41 抗体以观察血小板。根据检测到的血小板(CD41 阳性)信号大小绘制直方图(最左侧面板)。d 感染 MA-SARS-CoV-2 的中性粒细胞耗竭 Ob/Ob 小鼠的存活率和体重变化。给 Ob/Ob 小鼠注射抗 Kappa 免疫球蛋白抗体和抗 Ly-6G 抗体以消耗中性粒细胞。用 104 PFU 的 SARS-CoV-2-Venus 感染小鼠,连续 14 天每天监测存活率和体重。结果以平均值 ± SD 表示。
5
肺中性粒细胞粘附分子表达的改变与 COVID-19 严重程度的关系
中性粒细胞通过粘附分子与血管内皮细胞相互作用而浸润感染部位。因此,我们通过流式细胞术分析了 SARS-CoV-2 感染小鼠中性粒细胞浸润过程中与血管内皮细胞相互作用相关的分子(即 CD62L、CD44、Eselectin、Selplg 和 Pecam-1)22 的表达水平。感染 MA-SARS-CoV-2 的 Ob/Ob 小鼠肺血管中的中性粒细胞表现出 CD62L、CD44 和 E 选择素表达上调(图 7)。对该小鼠模型的分析表明,SARS-CoV-2 增加了中性粒细胞对血管壁的粘附并诱导血小板聚集,从而导致肺灌注受损。

图 7 MA-SARS-CoV-2 感染小鼠肺部血管中性粒细胞上粘附分子的表达。C57BL/6J 小鼠和 Ob/Ob 小鼠在 4 dpi 时肺部血管中性粒细胞上所述粘附分子阳性率的测定。每个面板中的横杠表示确定为阳性的粘附因子的表达水平。天真小鼠,n = 4。4dpi时,CD62L(WT,n = 6;Ob/Ob,n = 7)、CD44和E-选择素(WT,n = 6;Ob/Ob,n = 6)、Selplg(WT,n = 3;Ob/Ob,n = 3)和Pecam-1(WT,n = 7;Ob/Ob,n = 7)。每个点代表一只动物的数据,横杠代表平均值 ± SD。
最后,为了确定在 SARS-CoV-2 感染小鼠的严重感染中观察到的血管中性粒细胞表面粘附分子表达水平升高是否与人类 COVID-19 肺炎的发病机制有关,我们分析了 COVID-19 患者临床样本中粘附相关基因表达的已发表数据。我们利用两个已发表的来自健康志愿者、COVID-19 轻度和重度病例的外周血单核细胞(PBMCs)的 scRNA-seq 分析数据集,分析了 474 个粘附相关基因24 的表达变化,发现在两个数据集中,健康组和重度组的四个基因(CD44、SELL、ICAM3 和 CD93)的表达水平经常不同(图 8a,b)。在与中性粒细胞相对应的子集中,COVID-19 重症病例中 CD44 和 SELL(编码 CD62L)基因的表达水平与健康人相比明显升高(图 8c)。这些发现表明,在 COVID-19 重症病例的肺部血管中性粒细胞中,粘附分子的表达也增加了,支持了在小鼠中获得的数据的相关性。相反,与健康组相比,重症组ICAM3 和 CD93 的基因表达明显下降。在 Wilk 等人和 Xu 等人的数据集中,SELL 基因的表达水平与 COVID-19 的严重程度呈正相关;在 Xu 等人的数据集中,CD44 基因的表达水平与 COVID-19 的严重程度也呈正相关;在 Wilk 等人的数据集中,当对健康与非通气患者或通气患者进行比较时,CD44 基因的表达水平呈正相关。相比之下,ICAM3 和 CD93 基因的表达水平与严重程度呈负相关,这表明它们可能是 COVID-19 严重程度的分子标记。最后,使用抗 CD44 和抗 CD62L 抗体阻断粘附分子的功能可减少感染 SARS-CoV-2Venus 的 Ob/Ob 小鼠肺部中性粒细胞与血管壁的接触时间,并增加流入血液的中性粒细胞百分比(图 9a、b 和补充影片 7)。相反,使用抗 CD44 和抗 CD62L 抗体抑制 CD44 和 CD62L 的功能并不会影响 SARS-CoV-2 感染后血小板聚集的大小(图 9c)。

图 8 COVID-19 肺炎中肺部中性粒细胞粘附分子的参与。 a-c 分析已发表的 COVID-19 临床样本 sc-RNA-seq 数据集[Wilk 等人 9 和 Xu 等人 23]。a 根据每个细胞的基因表达对 COVID-19 患者的外周血单核细胞进行聚类,并绘制成 UMAP 图(上图)。b COVID-19 患者外周血单核细胞中性粒细胞粘附相关基因的火山图。与(a)中性粒细胞相对应的簇中共分析了 474 个粘附相关基因。紫色图表示健康病例和重症病例之间表达明显改变的基因,灰色虚线表示 BH 校正后的 p 值为 0.05。c PBMC 中性粒细胞中四个粘附相关基因表达的 Violin 图,这四个基因在健康病例和重症病例两个数据集中的表达经常发生明显改变。NonVent(不通气)和 Vent(通气)分别表示 COVID-19 的轻度和重度病例9 。每个点代表单个细胞的数据。

图 9 抗 CD44 和抗 CD62L 抗体对中性粒细胞运动和血小板聚集的影响 a Ob/Ob 小鼠经鼻感染 104 PFU MA-SARS-CoV-2-Venus,感染后第 1、2 和 3 天,静脉注射抗 CD44 和抗 CD62L 抗体。感染后第 4 天,给小鼠静脉注射氟铬结合的抗 Ly-6G 抗体,以追踪中性粒细胞的移动。进行追踪分析以获得单个中性粒细胞的运动轨迹(左图,血管结构以白色显示,单个运动轨迹以不同颜色编码)。根据检测到的血小板(CD41 阳性)信号的大小绘制直方图(最左侧面板)。
讨论
在本研究中,我们的体内成像系统显示,在 SARS-CoV-2 感染的肺中,肺血管中的中性粒细胞数量增加,中性粒细胞的运动能力下降。我们还发现,受感染的肺中血小板聚集增强,中性粒细胞-血小板复合物频繁形成。在受感染的小鼠肺中,红细胞流经进行氧气交换的血管数量减少,这表明这可能是 SARSCoV-2 致病的原因之一。此外,我们还发现 COVID-19 患者和小鼠模型的肺中性粒细胞中粘附分子的表达增加,这表明 SARS-CoV-2 在人类和小鼠中存在共同的致病机制。因此,我们的体内成像分析揭示了 SARS-CoV-2 发病的新机制,这是传统的组织病理学、组织化学分析和流式细胞术所无法发现的。
对严重或致命 SARS-CoV-2 感染小鼠模型的分析表明,中性粒细胞粘附在肺血管壁上会诱发血小板聚集,导致肺灌注受损。COVID-19 患者血栓形成的一个主要机制被认为是中性粒细胞释放的 NETs 诱导血小板聚集和血栓形成。在 COVID-19 患者的肺部尸检中发现了中性粒细胞、血小板和瓜氨酸组蛋白 H3(NETs 的标记物)的复合物。与这些发现相一致的是,对人类 scRNA-seq 数据的分析表明,负责 NET 释放的 PADI4 基因的表达存在差异(补充图 3),这表明在严重的 COVID-19 病例中诱导了 NETs 的释放。然而,感染肺部的血管内中性粒细胞具有明显的细胞膜形状和缓慢的运动,并没有表现出与 NETs 释放相关的凋亡形态。这种差异可能反映了体内血栓形成的多步骤性质;我们发现的中性粒细胞粘附血管壁诱导血栓形成的现象可能早于NETs参与的血栓形成。由于中性粒细胞释放的 NETs 是对 PAMPs 和 DAMPs 的诱导反应,因此,NETs 很可能是对组织损伤后释放的 DAMPs 的反应,并在感染晚期感染程度较深时诱导血栓形成。我们的活体成像分析很可能揭示了血栓形成的早期阶段,而 COVID-19 的尸检病例中并不存在这种情况。
在 SARSCoV-2 感染小鼠的肺血管内中性粒细胞中,粘附分子 CD44 和 CD62L 的表达上调,在严重 COVID-19 病例的肺中性粒细胞中,编码这些因子的基因的表达水平也上调。CD62L 在白细胞上表达,参与细胞间粘附;它广泛参与免疫细胞反应,从细胞迁移到抗原呈递。在中性粒细胞中,CD62L 从祖细胞分化的早期阶段就开始在膜表面表达,并参与迁移过程中与血管内皮细胞的粘附。成熟的中性粒细胞在血液中的半衰期约为 6-12 小时,CD62L 的表达随着中性粒细胞的衰老而减少,衰老的特征是质膜不稳定、凋亡信号激活和其他事件。在 COVID-19 患者的肺部已观察到中性粒细胞浸润,成熟和未成熟中性粒细胞的数量均有增加。此外,有报道称未成熟的异常中性粒细胞通过 S100A8/A9TLR4 途径浸润感染 SARS-CoV-2 的小鼠肺部,并参与了发病机制。据报道,COVID-19 患者也会出现中性粒细胞减少症,即血液中中性粒细胞数量增加,而在我们的小鼠模型中,SARS-CoV-2 感染会增加肺血管中中性粒细胞的数量。最近,Castanheira 等人报道,在一个泛表达 hACE2(CAG-AC-70)的小鼠模型中,感染 SARS-CoV-2 会增加肺血管中的中性粒细胞数量。这些研究结果表明,SARS-CoV-2 感染促进中性粒细胞在骨髓中增殖并迁移到受感染的肺部,大量表达高水平 CD62L 的未成熟中性粒细胞被招募到受感染的肺血管中,导致血栓形成和肺灌注受损。与这一假设相一致,在本研究中,我们发现与健康对照组相比,重症 COVID-19 患者的中性粒细胞中 ICAM3 的表达水平显著下降,而 ICAM3 是细胞凋亡信号诱导的膜分子之一。
CD44 也是一种在白细胞上表达的粘附因子,参与中性粒细胞对肝窦的粘附和浸润。有报道称,在 LPS 诱导的肝损伤中,Cd44 基因缺陷小鼠肝窦内的中性粒细胞粘附受到抑制。虽然 Cd44 基因在中性粒细胞中的表达机制仍不清楚,但我们知道单核细胞在炎症细胞因子的作用下 Cd44 的表达会增加。在 COVID-19 的严重病例中,SARSCoV-2 感染诱导的炎症介质也可能增加中性粒细胞中 CD44 基因的表达,从而导致与肺血管的粘附增加。此外,有报道称,在 LPS 诱导的脓毒症小鼠模型中,中性粒细胞对肺血管的粘附增加,导致血流受阻和中性粒细胞中粘附分子(CD11b 和 CD18)的表达增加。因此,中性粒细胞中上调的粘附分子引起肺血流障碍的病理机制可能是某些炎症的共同机制。
我们的研究存在一些局限性,需要进一步研究。本研究未检测 SARS-CoV-2 感染肺部血管内皮细胞膜分子表达水平的变化,目前尚不清楚血管内皮细胞是如何参与中性粒细胞粘附到肺血管壁的。有一种假设认为,血栓的形成是由于血管内皮细胞对 SARS-CoV-2 感染的机能障碍。然而,至少在我们的小鼠模型中,中性粒细胞对血管壁的粘附不仅发生在受感染的血管内皮细胞附近,也发生在远离 SARS-CoV-2 感染细胞的地方(图 1b 和 5a)。另一个局限性是,目前还不清楚在 SARS-CoV-2 感染小鼠模型和 COVID-19 患者中,CD44 和 SELL 基因的上调是发生在整个中性粒细胞群体中,还是发生在中性粒细胞的某些亚群中。许多关于中性粒细胞异质性的报道表明,SARS-CoV-2 感染可能诱导中性粒细胞亚群高水平表达 CD44 或 SELL 基因。此外,中性粒细胞粘附在肺血管壁上导致的肺灌注受损在多大程度上导致了 SARS-CoV-2 肺炎的致死率尚不清楚。最后,用中和抗体阻断粘附分子的功能可减少感染 SARS-CoV-2-Venus 的 Ob/Ob 小鼠肺部中性粒细胞与血管壁的接触时间;然而,抑制 CD44 和 CD62L 的功能并不会显著影响血小板聚集的大小(图 9a-c)。因此,除 CD44 和 CD62L 外,通过抑制粘附因子的功能可能会更明显地改善病理状况。由于粘附分子参与了中性粒细胞对 SARS-CoV-2 感染的迁移和浸润反应,中和抗体对粘附分子的功能障碍也可能干扰中性粒细胞对 SARS-CoV-2 感染的保护功能,这一点尚未得到充分探讨。
除急性呼吸道感染外,有报道称 COVID-19 后遗症(又称长期 COVID)还包括呼吸急促、咳嗽、关节痛、肌痛、疲劳、头痛、气味/味觉障碍和心悸等症状,甚至在感染缓解后仍会出现这些症状。研究表明,严重 COVID-19 的高危人群,尤其是老年人和体重指数(BMI)高(肥胖)的人群更容易出现长时间的缺血后症状。还有人认为,微栓塞引起的组织损伤可能会导致 COVID-19 后遗症。在本研究中,我们利用小鼠模型的活体成像发现,由中性粒细胞和血小板组成的微血栓的形成会损害肺血流并加重 COVID-19 肺炎。本研究揭示的 COVID-19 的病理机制将为重症 COVID-19 和长程 COVID 患者开发出更有效的治疗方法。
材料与方法
1. 伦理声明
所有实验均在东京大学经日本农林水产省批准的强化生物安全三级(BSL3)隔离实验室中进行。动物研究方案已获得东京大学批准(批准号分别为 PA19-72 和 PA21-07)。动物设施的环境温度为 25 °C,湿度为 50%。实验开始前,动物已适应实验设施,维持 12 小时开/关的光照周期,并可自由获取食物和水。
2. 病毒
我们通过反向遗传学方法制备了插入荧光报告基因 Venus 的 SARS-CoV-2-Venus 病毒。在构建SARS-CoV-2-Venus时,我们通过重组将pBAC SARS2 wk521的ORF 8基因替换为Venus基因,并将感染性cDNA克隆命名为pBAC SARS-CoV-2Venus。小鼠适配(MA)-SARS-CoV-2 和 MA-SARS-CoV-2-Venus 也是通过先前描述的反向遗传学方法产生的20。病毒株在 VeroE6/TMPRSS2 (JCRB 1819) 细胞中繁殖45。
3. 细胞
VeroE6/TMPRSS2 (JCRB 1819) 细胞45 在含有 10%小牛血清(FCS)的杜氏改良老鹰培养基(DMEM)中,以 1 mg/ml 遗传因(G418;Invitrogen 公司)和 5 μg/ml 疟原虫预防素(Invitrogen 公司)进行繁殖。定期用 PCR 检测细胞是否受支原体污染,并确认不含支原体。
4. 小鼠
8周龄半杂合子K18-hACE2 C57BL/6J雌性小鼠(品系2B6.Cg-Tg(K18-ACE-2)2Prlmn/J)、24周龄C57BL/6J HamSlc-ob/ob雌性小鼠和5周龄链脲佐菌素(STZ)诱导的糖尿病C57BL/6J雄性小鼠购自日本杰克逊实验室。此外,24 周大的 B6-NASH 雄性小鼠、B6. KOR/StmSlc-Apoeshl雌性小鼠、SAMR1/TaSlc[衰老加速小鼠(SAM);抗衰老近交系(R)]雄性小鼠、SAMP8/TaSlc[衰老加速小鼠(SAM);易衰老近交系(P)]雄性小鼠和SAMP10-ΔSglt2雄性小鼠购自日本SLC公司。KK-Ay /Ta Jcl 雌性小鼠(24 周龄)购自 CLEA Japan Inc. 作为对照的年龄和性别匹配的 C57BL/6J 小鼠与各疾病模型小鼠品系购自同一供应商。八周龄的 k18-hACE2 Tg 小鼠被用于分析,因为与同龄的野生型小鼠相比,它们表现出严重的 SARS-CoV-2 肺炎。除 STZ 诱导的 1 型糖尿病小鼠模型外,患有基础疾病的转基因小鼠品系均在 24 周龄时匹配。STZ 诱导的 1 型糖尿病模型小鼠在未接受治疗的情况下会在数周内死亡,因此我们必须在 STZ 治疗后(5 周龄时)立即使用这些小鼠进行感染实验。在本研究中,我们使用的是雌性小鼠,这与我们之前的研究一致20,46。对于 STZ 诱导的糖尿病小鼠和 SAMR1/P8/P10 小鼠,我们使用了供应商提供的雄性小鼠。
5. 小鼠实验感染
给小鼠鼻内接种 101 -105 PFU 的 SARS-CoV-2-Venus、MA-SARS-CoV-2 或 MA-SARSCoV-2-Venus。感染前和感染后每天测量体重。用 104 PFU 的 MA-SARS-CoV-2-Venus 经鼻感染 C57BL/6J HamSlc-ob/ob小鼠,并在感染后的第 1、2 和 3 天静脉注射 100 µg 抗小鼠 CD44(IM7,Bioxcell)和抗小鼠 CD62L(Mel14,Bioxcell)抗体或相应的同型对照(2A3 和 LTF-2,Bioxcell)。
6. 病理学检查
切除的肺组织在 4% 多聚甲醛磷酸盐缓冲溶液中固定,然后进行石蜡包埋处理。将石蜡块切成 3 微米厚的切片,然后使用标准苏木精和伊红程序对切片进行染色。此外,用兔多克隆 SARS-CoV 核壳蛋白抗体(ProSpec;ANT-180,1:500 稀释度,Rehovot)对组织切片进行染色,以进行免疫组化分析。使用 Dako Envision 系统(Dako Cytomation;K4001,1:1 稀释度)对特异性抗原-抗体反应进行 3,3′二氨基联苯胺四盐酸盐染色。肺炎的组织病理学评分基于肺切片特定区域的肺泡炎症百分比(面积分)、炎症细胞密度(密度分)以及是否存在肺水肿和/或肺泡出血(严重程度分),采用的评分系统如下:面积分 0 分,无炎症;1 分,受影响面积(≤50%);2 分,受影响面积(50%)。密度 0 分,仅在高倍视野中观察到炎症;1 分,在低倍视野中观察到炎症;2 分,肺泡充满炎症细胞。严重程度评分 0 分,无肺水肿和/或肺泡出血;1 分,有肺水肿和/或肺泡出血。每只动物五个肺叶的总分都是计算出来的;因此,每只动物的得分在 0 到 25 之间。
7. 病毒滴定试验
给 C57BL/6J 小鼠和 HamSlc-ob/ob 小鼠鼻内接种 103 PFU 的 MA-SARS-CoV-2。感染后 2 天和 5 天(dpi),对动物实施安乐死并收集其器官(肺、鼻甲、脑、心、肝、脾、肾和肠)。用 100 μl 器官匀浆稀释液感染 12 孔板中的 VeroE6/TMPRSS2 细胞。在 37 ℃ 下培养 1 小时后移除病毒接种体,然后在细胞上覆盖 DMEM 中的 1% 琼脂糖溶液。培养 48 小时后,用 10%中性缓冲福尔马林固定琼脂覆盖的细胞。去除琼脂后对斑块进行计数。
8. 显微 CT 成像
给 C57BL/6J 小鼠和 HamSlc-ob/ob 小鼠鼻内接种 103 PFU 的 MA-SARS-CoV-2。使用体内微型 CT 扫描仪(CosmoScan FX; Rigaku)对感染小鼠的肺部进行成像。在氯胺酮-恶嗪麻醉下,将动物放入成像室,在 90 kV、88 μA、FOV 45 mm、像素 90.0 μm 的条件下扫描 2 分钟。扫描结束后,使用 Micro-CT 3.5.5.100 版 CosmoScan 数据库软件(理学公司)重建肺部图像,并使用制造商提供的软件进行分析。
9. 小鼠肺部活体成像
使用配备红外激光器(Chameleon Vision II,Coherent)的 LSM 980 NLO(卡尔蔡司)进行体内成像10,11。用 105 PFU SARSCoV-2-Venus 或 104 PFU MA-SARS-CoV-2-Venus 感染 K18-hACE2 小鼠、C57BL/6J 小鼠和 C57BL/6J HamSlc-ob/ob 小鼠。受感染的小鼠在麻醉状态下插管,以每分钟 120 次的呼吸频率通气。持续注射 2% 的异氟醚以维持麻醉。暴露小鼠的左肺叶,用特制的胸腔吸引窗轻轻固定。在所有实验中,成像前静脉注射德克萨斯红葡聚糖(70,000 Da,Invitrogen)、5 µg 结合了植物红蛋白(PE)的大鼠抗小鼠 CD41 抗体(MWReg30;BD Biosciences)和 5 µg 结合了 Alexa Fluor 594 的大鼠抗小鼠 Ly-6G 抗体(1A8,Biolegend),以分别观察肺血管结构、血小板和血管中性粒细胞。为了分析肺灌注,给感染 SARS-CoV-2-Venus 或 MA-SARS-CoV-2Venus 的小鼠静脉注射 Dio 标记的红细胞。按照之前的描述37,生成了指定帧(0-10 分钟)的最大强度投影,以显示红细胞灌注的功能性毛细血管。在光谱成像模式下获取图像时,使用波长为 488 nm、543 nm 和 910 nm 的激光同时激发荧光素和维纳斯。波长介于 490 纳米和 695 纳米之间的所有发射光均由 20× 水浸透透镜(卡尔蔡司)检测。通过使用 LSM 软件 ZEN blue 3.3(卡尔蔡司)的线性非混合功能对获取的λ堆栈进行光谱分离。处理、化验和数据可视化均使用 CellProfiler 4.2.4(Broad Institute)和内部 MATLAB(2022a)脚本(MathWorks)进行。用 TrackMate(ImageJ,NIH)追踪去噪影片中的中性粒细胞。
10. 流式细胞术
根据流式细胞仪(FCM)生产商的说明,使用肺解离试剂盒(Miltenyi)和gentleMACS Dissociator(Miltenyi)对小鼠肺进行解离。红细胞裂解后,样本经 70-μm 过滤器(Miltenyi)过滤,重悬后进行 FCM 染色。在血管内中性粒细胞染色实验中,小鼠在肺收集前 5 分钟静脉注射 5 µg PE 结合物大鼠抗小鼠 Ly-6G 抗体(1A8,Biolegend)。细胞表面染色时,在含 0.5% BSA 和 2 mM EDTA 的 PBS 中用抗体染色 10 分钟。以下抗体克隆经 1:100 稀释后用于这些研究:Vio-Green-CD45 (REA737, Miltenyi)、PE-NK1. 1(REA1162,Miltenyi)、PE-Vio615-CD4(REA604,Miltenyi)、PE-Vio770B220(REA755,Miltenyi)、APC-CD3(REA641,Miltenyi)、APC-Vio770CD8a(REA601、 Miltenyi)、Vio-Blue-MHC class II(REA813,Miltenyi)、FITC-Ly-6C(REA796,Miltenyi)、PE-Vio615-Ly-6G(REA526,Miltenyi)、 PE-Vio770-CD11c(REA754,Miltenyi)、APC-Siglec-F(REA798,Miltenyi)、APC-Vio770-CD11b(REA592,Miltenyi)、APC-CD44(IM7 Biolegend)、 APC-Pecam-1(W18222B,Biolegend)、APC-CD62L(MEL-14,Proteintech)、APC-CD62E(P2H3,Invitorogen)和 APC-CD162(4RA10,Elabscience)。APC 与抗 CD62E 小鼠 IgG1 抗体的连接是使用 APC 标记试剂盒-NH2(Wako)按照生产商的方案进行的。
11. 免疫细胞群定义如下
B 细胞(CD45+ CD3- B220+ )、NK 细胞(CD45+ CD3- B220- NK1. 1+ )、CD4 T 细胞(CD45+ CD3+ B220- CD4+ CD8- )、CD8 T 细胞(CD45+ CD3+ B220- CD4- CD8+ )、肺泡巨噬细胞(CD45+ CD11bdim Siglec-F+ CD11c+ MHC class II+ )、树突状细胞(CD45+ CD11b- Siglec-F- CD11c+ )、 中性粒细胞(CD45+ CD11bhigh Ly-6G+ )、嗜酸性粒细胞(CD45+ CD11bhigh Siglec-F+ Ly-6G- CD11c- )和单核细胞(CD45+ CD11bhigh Siglec-F- Ly-6G- MHC class II- Ly-6Chigh)。样本在流式细胞仪(MACSQuant Tyto,Miltenyi)上进行分析。
12. 中性粒细胞运动分析
为了跟踪中性粒细胞的运动,向小鼠体内静脉注射 5 µg PE 结合的大鼠抗小鼠 Ly-6G 抗体。中性粒细胞以大约 4 帧/秒的速度成像,持续时间为 230 秒。所有影片都经过呼吸运动伪影校正和去噪处理。使用 TrackMate(ImageJ,NIH)进行单个物体追踪,以获得单个中性粒细胞的运动轨迹。对于每个中性粒细胞,我们都测量了其运动轨迹中各个步骤的速度,然后将其定义为慢速(≤50 µm/s)或快速(>50 µm/s)。然后,我们检查了中性粒细胞是否进行了快速运动,并计算了中性粒细胞在不被快速运动打断的情况下进行连续慢速运动的持续时间。
13. 血小板聚集的定量
使用 CellProfiler(Broad Institute)以半自动方式检测 CD41 信号,然后根据信号大小将其分为三个群体:信号覆盖面积小于 8.57 µm2(50 像素)的被定义为 “单个血小板”,信号≥8.57 µm2且小于 34.28 µm2(200 像素)的被定义为 “聚集血小板”,信号≥34.28 µm2的被定义为 “血小板”。CD41 信号的频率分析使用内部 MATLAB 脚本(MathWorks)进行。
14. 体内中性粒细胞耗竭
如前所述,在感染前两天,每天给 C57BL/6J HamSlc-ob/ob 注射 100 µg 抗大鼠 Kappa 免疫球蛋白(MAR18.5,Bioxcell)47。此外,从感染前一天开始,每隔一天给小鼠注射 50 µg 抗 Ly-6G(1A8,Bioxcell)和相应的同型对照(2A3,Bioxcell)。当小鼠连续注射两种抗体时,注射间隔时间应超过 2 小时。
15. 重新分析 scRNA-seq 数据
我们重新分析了两个已发表的健康人和 SARS-CoV-2 感染者的 PBMC scRNA-seq 数据集9,23。对于 Wilk 等人9 发表的数据,我们从 Wellcome Sanger 研究所托管的 COVID-19 细胞图谱 (https://www. covid19cellatlas.org/#wilk20)中以 RDS 文件的形式获得了经过嵌入、聚类和细胞类型分配等预处理的 scRNA-seq 计数数据。对于 Xu 等人23 发表的数据,我们从 NCBI(GSE216020)下载了转录本细胞矩阵,并使用 Seurat v448 软件包和 DoubletFinder49 进行了预处理,后者可识别并移除潜在的双重23。UMI 计数少于 500 个、检测到的基因少于 200 个、线粒体基因计数超过 20% 的细胞作为低质量细胞和潜在双倍细胞被剔除。使用 Seurat 中的 FindIntegrationAnchors 和 IntegrateData 功能对所有样本进行数据整合,并使用 FindVariableFeatures 功能选出前 3000 个可变基因。细胞类型注释基于 FindAllMarkers 功能定义的每个群组的标记基因。两个数据集(Wilk et al 和 Xu et al)中对应于中性粒细胞的子集分别用于与细胞粘附24 和中性粒细胞胞外诱捕网形成(KEGG:hsa04613)相关的差异基因表达分析。
16. 统计和重现性
所有动物均随机分配到实验组。所有实验均未进行盲法。样本量基于我们之前的工作。所有数据均使用 GraphPad Prism 10.3.1、R 4.1.0 和 Rstudio 2023.06.1+524 进行分析,当 P 值小于 0.05 时,差异被认为具有统计学意义。除 scRNA-seq 数据的差异基因表达分析外,未进行多重比较调整(图 8c 和补充图 3)。对于图 1d、2b、d、5c、d、f 和 9b,数据采用非参数、双尾学生 t 检验进行分析,p 值显示在各图中。对于图 2c,数据采用邓尼特检验进行分析,p 值显示在图中。图 4a、e、5b 和 7 采用 Sidak 检验对数据进行分析,p 值见各图。图 4d 的数据采用 MannWhitney 检验进行分析。对于图 8c 和补充图 3,数据采用 Wilcoxon 符号秩检验进行分析,P 值采用 Benjamini-Hochberg 程序进行校正,并显示在各图中。图 1b-d、2d、e、4b、5a 和 6a、b 至少进行了三次实验,实验动物在生物学上是独立的,并得到了相似的结果。图 2d 是一张从图 1b 裁剪下来的显微照片。
参考文献:
Ueki H, Wang IH, Kiso M, Horie K, Iida S, Mine S, Ujie M, Hsu HW, Wu CH, Imai M, Suzuki T, Kamitani W, Kawakami E, Kawaoka Y. Neutrophil adhesion to vessel walls impairs pulmonary circulation in COVID-19 pathology. Nat Commun. 2025 Jan 13;16(1):455. doi: 10.1038/s41467-024-55272-0. PMID: 39805823; PMCID: PMC11730596.